引言
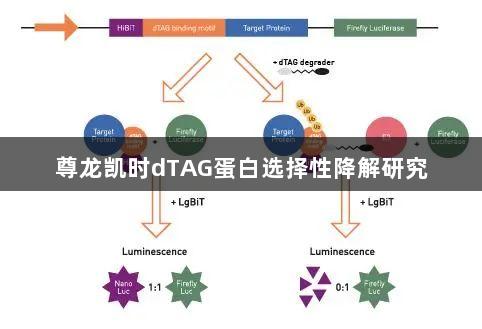
靶向蛋白质降解是一种前沿的生物医疗策略,旨在治疗过程中选择性地从细胞中去除特定蛋白质。虽然最早的研究主要集中在PROTAC分子上,但目前新的靶向降解方法不断涌现,其中之一是降解TAG(dTAG)技术。dTAG作为一种创新的靶标验证手段,采用异双功能小分子的方式,构建目标蛋白与E3泛素连接酶之间的三元复合物。dTAG的独特之处在于,利用CRISPR/Cas9技术将双功能降解剂的一部分结合位点嵌入目标蛋白,从而成为验证靶标及探讨剂量依赖效应的理想工具。
本文中提到的dTAG蛋白降解分析采用双荧光素酶报告系统来评估靶蛋白的降解情况。在此方法中,萤火虫荧光素酶被作为基准标记物,其光信号不受dTAG降解的影响。另一种荧光素酶是纳米荧光素酶(Nanoluciferase),其以非活性的形式与靶蛋白进行融合。dTAG降解剂通过引入dTAG结合基序,将靶蛋白与E3泛素连接酶连接,从而形成三元复合物,导致靶蛋白及其融合的HiBiT片段的泛素化和随之而来的降解。
为了测量纳米荧光素酶的荧光发射,需在降解后加入LgBiT,该小片段能够完成未降解的HiBiT片段,形成活性的纳米荧光素酶,并产生荧光信号。纳米荧光素酶与萤火虫荧光素酶的发射比值反映了dTAG降解剂的效能,比例越低则表示目标降解程度越高。
研究目标
本研究旨在通过对dTAG结构的优化,改善已有dTAG框架的动力学特性。为此,研究团队将不同dTAG降解剂或DMSO对照物分配至1536孔微孔板中。使用稳定转染的HEK293细胞,在进行细胞悬液处理后,将其注入微孔板中。经过孵育与处理后,通过萤火虫荧光素酶和纳米荧光素酶的发射测定目标蛋白的降解情况。
在评估dTAG降解酶的实验中,研究了不同dTAG分子(如dTAG-v2、dTAG-47和dTAG-13)在诱导HiBiT靶向降解的能力。以递增浓度(从0.1至10,000 nM)应用于表达HiBiT的细胞中,测试结果显示,所有dTAG降解剂均呈现出浓度依赖性的降解效果,但不同分子在HiBiT降解程度上有所差异。
此外,还对dTAG-v1的稳定性进行了评估,包括浓度范围在1至10µM的多次重复实验。结果表明,与DMSO对照组相比,所有浓度的dTAG-v1均能有效引起HiBiT融合蛋白的降解,且纳米荧光素酶的化学发光信号随浓度降低而减少。
结论
通过dTAG蛋白质降解检测,所测试的dTAG分子能够成功地诱导HiBiT融合蛋白的靶向降解。考虑到其高灵敏度、短时间读取和兼容缩小规模的优点,尊龙凯时的PHERAstarFSX酶标仪在此应用中展现出良好的性能,媲美其他类似设备,能够为生物医疗领域提供更为精准的检测解决方案。


